健康食品の新制度 問われる新市場への“対応力”

科学的根拠、競争力に
政府は今年6月、健康食品の新たな機能性表示制度を導入することを決めた。これまであいまいな表現で製品の情報を提供せざるを得なかった健食業界にとって、適切な情報提供を行える機会が得られるのは福音と言える。ただ、表示は、米国制度を参考に企業自ら根拠を持ち、自己責任で行うのが前提。今のところ事業者が捉える科学的根拠に統一的な尺度はなく、その要件の検討は、制度設計の焦点の一つにもなっている。だが、米国制度に通じる一部の企業は、海外の指針を参考に、すでに科学的根拠の整理を始めている。制度導入で変わる新たな市場への対応力の違いは、今後の競争環境を激変させることになる。
水面下で進む米制度の先取り
「米国 で製品のエビデンス(科学的根拠)とひもづけた表示の実績がある外資系企業は今、粛々と準備を進めている。この機会を活かそうと思うか、一歩引いている か、関心を示さないかで大きく差が出ると思う」。健食を扱う複数の企業のコンサルティングを行うある事業者はこう警鐘を鳴らす。
消費者 庁が検討する新制度では、表示を裏付けるための科学的根拠の要件について、何らかの指針が示されるとみられる。だが、これまで健食業界にはエビデンスに対 する一貫した判断基準はなかった。エビデンスは原料だけで良いのか製品でも必要か、試験は動物試験で良いのかヒト試験が必要か、そのレベルは学会発表で良 いのか論文掲載が必要か...。各企業なりの考え方で判断してきた。
日本には、固有の原料も多い。これから試験デザインを考えヒト試験を行 い論文投稿するとなると、最低でも1年から1年半はかかる。だが「多くの国内企業はのんびりしている。外資系には、"この部分のエビデンスが足りないから 取りにいこう"という企業もあり、国内企業でも"米国が示すエビデンスの要件で試験を組んでくれ"と先取りする企業もある」(前出関係者)と話す。
企業間で異なる根拠の捉え方
実際、企業のエビデンス蓄積に向けた取り組み状況はさまざまだ。
メーカー系通販A社では「原料レベルで文献を整理し、製品でも二重盲検試験(※)を行っている」という。すべての製品で二重盲検試験をやっているわけでは なく、学会報告レベルの研究もあるが、基本的に販売前に最終製品でヒト対象試験を行う。ただ、エビデンスが充実しているのは、主力製品のみ。今後、他の製 品のエビデンスの整理を進めるとしている。メーカー系通販B社は、「医薬品と同じ水準でやろうと始めたことなので、もともとエビデンスのある原料を扱い、 基本的に製品で二重盲検試験を行っている」とする。
一方、メーカー系通販C社は「原料のエビデンスは開発部門で文献検索している。た だ、製品でヒト対象試験は行っていない。モニター試験など、学会発表に至らない調査レベル」という状況。別の通販専業D社も「正直やっていない。原料レベ ルのエビデンスはメーカーに聞けば出てくると思うが、むしろ規制強化の動きに目がいっている」とする。
米指針、ヒト対象試験が大前提

日本の制度設計に先立ち、米国では日本の厚生労働省にあたるFDA(米食品医薬品局)が2009年、科学的根拠の要件に関する指針を示している。
米国の指針には強制力がなく、科学的な立証責任もFDAが負う。日本では景品表示法上の立証責任を企業が負うなど法律上の違いがあるため、日本で同じ要件を求められるかは分からない。ただ、米国を参考に設計されることは明らかだ。
ちなみに米国の指針では、二重盲検試験を「最も信頼のおける研究」と推奨。ヒトを対象にした試験を前提としており、動物試験や体験談などは単独で表示の根 拠とはなり得ないとしている。研究内容に関係する専門家の客観的評価を得ることや、海外の文献を活用する際には地域や人種の違いを考慮する必要性なども示 されている。
「エビデンス」とは、最低でも「専門家による査読(=評価)の有無に関わらず、論文掲載された研究」を指し、査読がある方 が良い。より良いのは、複数の論文をデータの偏りを考慮した上で比較分析した「システマティック・レビュー(=総合評価)」があること。一方で、学会発表 しただけで評価を受けない研究は論外で、科学的根拠とみなされない。
米制度に詳しい業界関係者は、「複数の成分を含む製品であれば、製品でエビデンスを持つことが望ましいが、今のところそこまでは求められていない。最低でも原料でヒト対象のエビデンスを2つ持つことが必要とされている」と、米市場の状況を説明する。
自社使用原料に根拠はあるか?
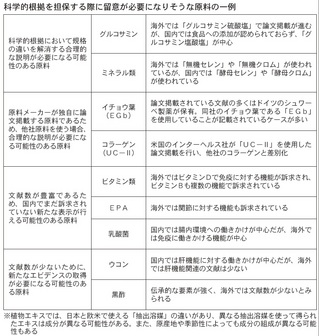
エビデンスを整理する上で注意しなければならないこともある。原料の中には、規格の違いから海外の文献を活用できないものもあるためだ。
例えば、グルコサミン。文献検索すれば広義の「グルコサミン」では文献が得られる。ただ、米国で使用されるグルコサミンは「グルコサミン硫酸塩」が主体。 そのため、海外から入手できる文献も「―硫酸塩」関係になる。だが、日本では食品に「―硫酸塩」を使うことができず「グルコサミン塩酸塩」が主体となって いる。規格の違いに対する説明を抜きに、ただちに論文を活用できるとは考えにくい。
イチョウ葉も海外で論文投稿されている文献の大半は、ドイツのシュワーベ製薬が保有するもの。違う原料メーカーが持つイチョウ葉のエビデンスとしてそのまま使えるかと言えば、同様の原料とみなす合理的な証明が必要になる可能性がある。
肝機能への働きに対する印象が強いウコンや、日本独自の原料である黒酢などは、これまでイメージで売られてきた。だが、ウコンの肝機能に対するエビデンス は海外に少なく、黒酢も海外で文献数が少ないことが予想される。エビデンスの蓄積が遅れれば、これまで通りイメージで売らなければならないが、消費者庁で はあいまいなイメージで売る製品に対する規制強化を明言してもいる。
◇
健食の新制度導入が決まる中、事業者には製品に使う原料のエビデンスの確認や、不足するデータの補完を検討することが求められる。
エビデンスだけでなく、これにひもづく広告表現の検証、使用原料の安全性情報の収集、GMPに準拠した工場における製造の検討など、取り組むべき課題は多い。対応力の差は、そのまま市場における競争力になる。
(※)医薬品の効果検証などに使われる試験。被験者の思い込み(プラセボ効果)による影響と観察者のバイアスを避けるため、薬の投与グループと非投与グループを被験者、観察者に知らせず行う試験。
必要な負担は?原料げヒト試験は必要?独自原料は負担トクホ並みか
消費者庁がどのような「科学的根拠の要件」を示すか、今後の検討になる。だが、海外でも通用するエビデンスとなると、最低でも原料レベルで「ヒト対象試験」に関するデータを持つことは必要になると思われる。
ヒト対象試験といってもその種類はさまざまだ。大きくは、「観察研究」と「介入研究」に分かれる。
「観察研究」とは、人為的な操作を行うことなく、研究者が仮説を立てた上で、疾病とその発生要因の関連を明らかにすること。イメージしやすい例は「フレンチパラドックス」を提唱した研究。ただ、数十年かけた追跡調査になることもあるため、企業が取り組む例は少ない。
一方の「介入試験」は、人為的に要因を加えたり、除いたりすることにより、その前後の疾病の変化を確かめる研究方法。試験法はいくつか種類があり、例えば 「ランダム化比較試験」であれば、成分を摂取する被験者、観察者双方が真薬か偽薬(プラセボ)か分からなくすることで、研究結果の正確性を担保する「二重 盲検試験」、一方のみ分からない状態にする「単盲検試験」がある。
このほか、被験者すべてに摂取してもらい、単純に前後の変化を確認す る「非ランダム化比較試験」がある。例えば、青汁のように見た目や味で本物でないことが分かってしまうような製品の場合、「二重盲検試験」を行うのが難し いため、こうした試験デザインが適する可能性がある。
◇
「二重盲検試験」とは聞きなれない言葉だが、一般的にトクホ取得の際によく使われる試験がこれになる。実施にかかる費用は「ざっくりと100人以上の被験者を対象にすれば5000万から1億円。20人程度であれば数百万円で済むケースもある」(業界関係者)という。
例えば、食後血糖値の変化を見る試験であれば、実施から変化を見るまでの期間は短くて済むが、数カ月後の血糖値の変化を見るとなると、試験期間も長くな る。被験者の数や試験に要する期間、試験デザインによっても費用は大きく変わるため、一概に費用は算出できない。国内外に自社製品に使う原料に関するエビ デンスがあればその整理で済むが、自社で行うとなると企業の負担は相当重くなる。
◇
ただ、今回の新制度で機能性の対象 範囲として加えられそうな「構造機能表示」(「目の健康に」など身体の構造に影響を及ぼす旨の表示)は、これまでトクホが担ってきた対象範囲でもある。" 国が認めたものではない"といった免責表示が義務づけられる可能性のある新制度と、国のお墨付きが得られる「トクホ」という違いがあり、トクホ並みの負担 を強いられることは考えにくい。
ただ、科学的根拠を持つために事業者に課せられる負担は、それなりに重いものとなるのは覚悟しなければならないだろう。